上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 DAPGreen – Autophagy Detection
DAPGreen – Autophagy Detection
DAPGreen – Autophagy Detection

- 細胞増殖/細胞毒性測定用試薬
- 細胞機能解析
- オートファジー
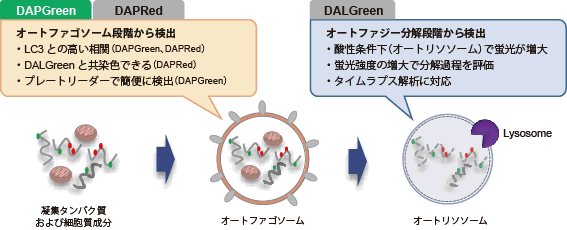
オートファジー(オートファゴソーム)の検出試薬
-
製品コードD676 DAPGreen – Autophagy Detection
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 5 nmol | ¥37,200 | 340-09291 |
 DAPGreenの最適濃度の検討については、
DAPGreenの最適濃度の検討については、
よくある質問の「DAPGreenの最適濃度の検討方法を教えてください」
をご覧ください。
- ご購入方法
- お問い合わせ
マニュアル
-
取扱説明書
 日本語
日本語 
-
取扱説明書
 English
English 
技術情報
技術情報の目次
- 原理
- 操作は試薬の添加だけ
- 検出試薬の概要
- LC3との高い相関
- Lamp1との共染色
- フローサイトでの定量解析
- プレートリーダーでの定量解析
- 応用例:蛍光顕微鏡での定量解析
- DAPGreenの励起、蛍光スペクトル
原理
 |
|
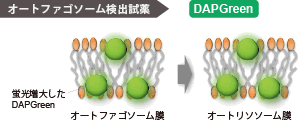 |
オートファゴソーム膜が形成される際に、DAPGreenは膜内に取り込まれ、脂溶性環境下に応答し蛍光が増大します。なお、オートファジーマーカーのLC3 を指標とした検出法とも高い相関性が得られています。 |
技術や使用製品に関する補足
グルタミン代謝とオートファジー
グルタミナーゼの安定化を介してオートファジーとグルタミノリシスを促進するタンパク質に関する報告例を紹介!
その他、疾患と細胞内代謝指標との関連性をマップでわかりやすく紹介しています。

参考文献
| 文献No. | 対象サンプル | 装置 | 引用(リンク) |
|---|---|---|---|
| 1) | 細胞 (HeLa, MEF) |
蛍光顕微鏡 |
H. Iwashita, H. T. Sakurai, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, K. Okuma, S. Shimizu, and Y. Ueno, "Small fluorescent molecules for monitoring autophagic flux.", FEBS Letters., 2018, 592, (4), 559–567. |
| 2) | 細胞 (HepG2; Huh-7) |
蛍光顕微鏡; フローサイトメーター |
L. Hu, T. Zhang, D. Liu, G. Guan, J. Huang, P. Proksch, X. Chen and W. Lin, "Notoamide-type alkaloid induced apoptosis and autophagy via a P38/JNK signaling pathway in hepatocellular carcinoma cells", RSC Adv., 2019, 9, 19855. |
| 3) | 細胞 (HepG2) |
蛍光顕微鏡 |
Q. Chu, S. Zhang, M. Chen, W. Han, R. Jia, W. Chen and X. Zheng, "Cherry Anthocyanins Regulate NAFLD by Promoting Autophagy Pathway", Oxid Med Cell Longev., 2019,DOI:10.1155/2019/4825949. |
| 4) | 細胞 (HLMVEC) |
蛍光顕微鏡 |
K. Koike, E. V. Berdyshev, A. M. Mikosz, I. A. Bronova, A. S. Bronoff, J. P. Jung, E. L. Beatman, K. Ni, D. Cao, A. K. Scruggs, K. A. Serban and I. Petrache, "Role of Glucosylceramide in Lung Endothelial Cell Fate and Emphysema", Am. J. Respir. Crit. Care Med., 2019,DOI:10.1164/rccm.201812-2311OC. |
| 5) | 細胞 (HeLa) |
蛍光顕微鏡 |
F. Hongbao,Y. Shankun, C. Qixin, L. Chunyan, C. Yuqi, G. Shanshan, B. Yang, T. Zhiqi, L. Z. Amanda, T. Takanori, C.Yuncong, G. Zijian, H. Weijiang and D. Jiajie , "De Novo-Designed Near-Infrared Nanoaggregates for Super-Resolution Monitoring of Lysosomes in Cells, in Whole Organoids, and in Vivo.", ACS Nano, 2019, 13, (12), 1446. |
| 6) | 細胞 (HeLa; A375) |
フローサイトメーター |
B. Yang, L. Ding, Y. Chen and J. Shi, "Augmenting Tumor-Starvation Therapy by Cancer Cell Autophagy Inhibition", Adv. Sci., 2020,DOI:10.1002/advs.201902847. |
| 7) | 細胞 (PC12) |
蛍光顕微鏡(超解像) |
Y. Tan, L. Yin, Z. Sun, S. Shao, W. Chen, X. Man,Y. Du and Y. Chen, "Astragalus polysaccharide exerts anti-Parkinson via activating the PI3K/AKT/mTOR pathway to increase cellular autophagy level in vitro.", Int. J. Biol. Macromol., 2020, DOI:10.1016/j.ijbiomac.2020.02.282. |
| 8) | 細胞 (Wild type Hepa 1-6) |
蛍光顕微鏡 (ImageJで数値化) |
Z. Peng, Y. Liao, X. Wang, L. Chen, L. Wang, C. Qin, Z. Wang, M. Cai, J. Hu, D. Li,P. Yao, A. K. Nüssler, L. Liu and W. Yang, "Heme oxygenase-1 regulates autophagy through carbon-oxygen to alleviate deoxynivalenol-induced hepatic damage., Arch. Toxicol., 2020, 94(2), 573. |
| 9) | 細胞 (マウス皮膚線維芽細胞) |
フローサイトメーター |
J. Kim, W.Y.Chee, N. Yabuta, K. Kajiwara, S. Nada and M. Okada, "Atg5-mediated autophagy controls apoptosis/anoikis via p53/Rb pathway in naked mole-rat fibroblasts", Biochem. Biophys. Res. Commun., 2020, 22, DOI:10.1016/j.bbrc.2020.05.083. |
| 10) | 細胞 (HeLa) |
蛍光顕微鏡(超解像) |
Q. Chen, M. Hao, L. Wang, L. Li, Y. Chen, X. Shao, Z. Tian, R. A. Pfuetzner, Q. Zhong, A. T. Brunger, J. Guan and J. Diao, "Prefused lysosomes cluster on autophagosomes regulated by VAMP8", 2021, doi:10.1038/s41419-021-04243-0. |
よくある質問
-
Q
DAPGreen working solutionは、どのくらい安定ですか?
-
A
DAPGreen working solutionの保存はできません。用時調製してください。
-
Q
DAPGreenのDMSO stock solutionは、どのくらい安定ですか?
-
A
DAPGreenのDMSO stock solutionは、調製後、-20℃、遮光下で保存してください。調製後1ヶ月間安定です。
また、使用量に応じて小分けし保存することをお勧めします。
-
Q
推奨の励起・蛍光フィルターを教えてください。
-
A
励起フィルター:425~475 nm
蛍光フィルター:500~560 nmなお、共焦点顕微鏡を用いて488 nm励起により蛍光観察した実績がございます。
弊社HP内の製品ページの実験例を参照ください。
-
Q
タイムラプスイメージングを行う上で注意点はありますか?
-
A
測定条件設定のための予備実験を行ってください。
試薬の特性上、染色直後は初期蛍光値が高くなる傾向があるため、以下の手順を参考に予備実験およびタイムラプスイメージングを行ってください。①予備実験
・コントロール細胞(オートファジーを誘導しない細胞)を用いる。
・取扱説明書に従い、Working soluitonで染色後、培養培地で2回洗浄する。
・通常培地を添加した後、蛍光の時間変化を観察する。
・下図の様に、染色後に細胞内の蛍光が次第に低下した後、蛍光の変化が安定してくる時間(図中 T)を確認する。
※条件は細胞の種類により変わる可能性があります。(参考)
HeLa細胞の場合、染色後の約60分経過すると蛍光強度が安定することを確認しております(DAPGreen)。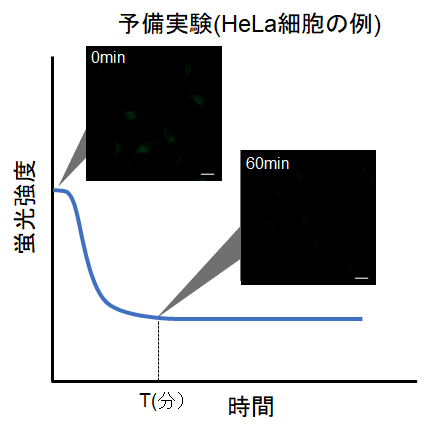
②タイムラプスイメージング
・細胞を Working solutionで染色後、培養培地中で細胞を37℃でインキュベートする。
※予備実験で設定した時間でインキュベートする。
※染色後、直ぐにはオートファジー誘導は行わない。
・インキュベート後にオートファジーの誘導を開始して、タイムラプスイメージングをする。(参考)
HeLa細胞をDAPGreenで染色し、通常培地中で60分間(予備実験で設定した時間)培養後、オートファジーを誘導しました。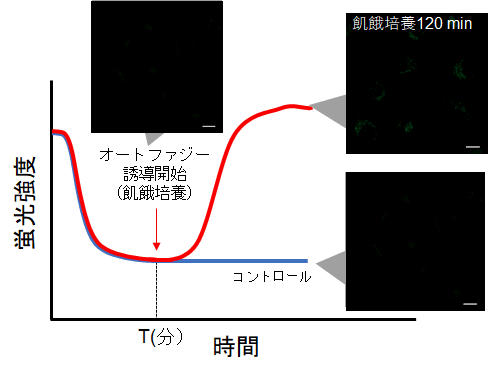
-
Q
DAPGreenの最適濃度の検討方法を教えてください。
-
A
試薬の特性により、試薬の濃度が高すぎたり低すぎたりすると、オートファジー誘導時と
誘導していないコントロールとの差が判りにくい場合があります。
下記の情報を参考に試薬濃度の検討することをお勧めします。細胞種によりDAPGreenの最適濃度は異なります。
DAPGreenを薄い濃度から(目安0.05 μmol/l)から数点段階的に振って
ご検討ください(濃い濃度は1 μmol/l前後を目安としてください)。(参考)
小社では、HeLa, HepG2、CHO細胞にて、細胞種毎のDAPGreenの最適濃度の検討を行いました。
DAPGreenを下記濃度で染色し、アミノ酸不含培地にて培養し、オートファジーを誘導しました。
その結果、下記の赤字の濃度条件ではコントロールとの差が見られました。細胞種 検討濃度 HeLa 0.4 µmol/l, 0.2 µmol/l, 0.1 µmol/l, 0.05 µmol/l HepG2 0.4 µmol/l, 0.2 µmol/l, 0.1 µmol/l, 0.05 µmol/l CHO 0.4 µmol/l, 0.2 µmol/l, 0.1 µmol/l, 0.05 µmol/l 【HeLa細胞】
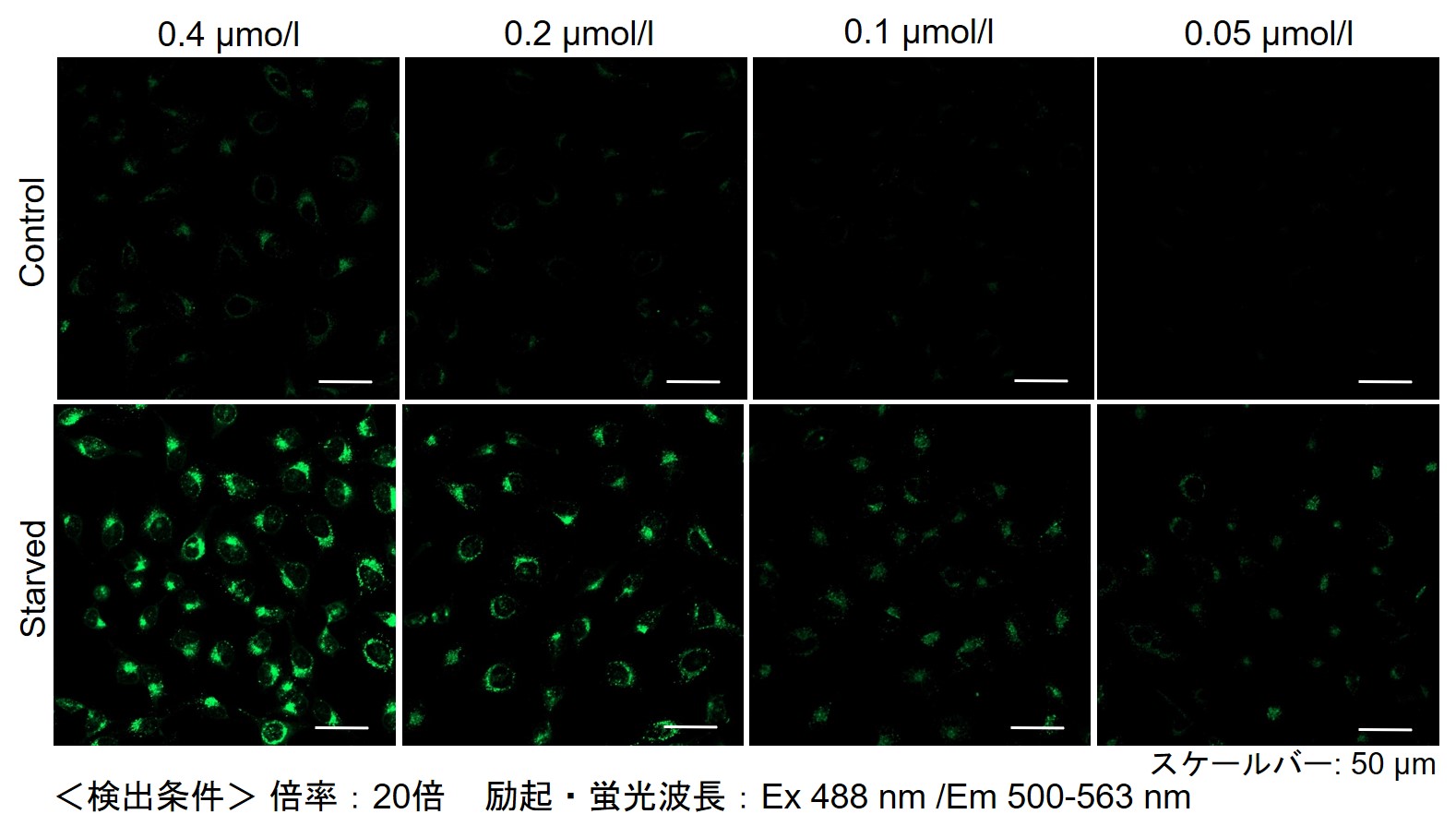
【HepG2細胞】
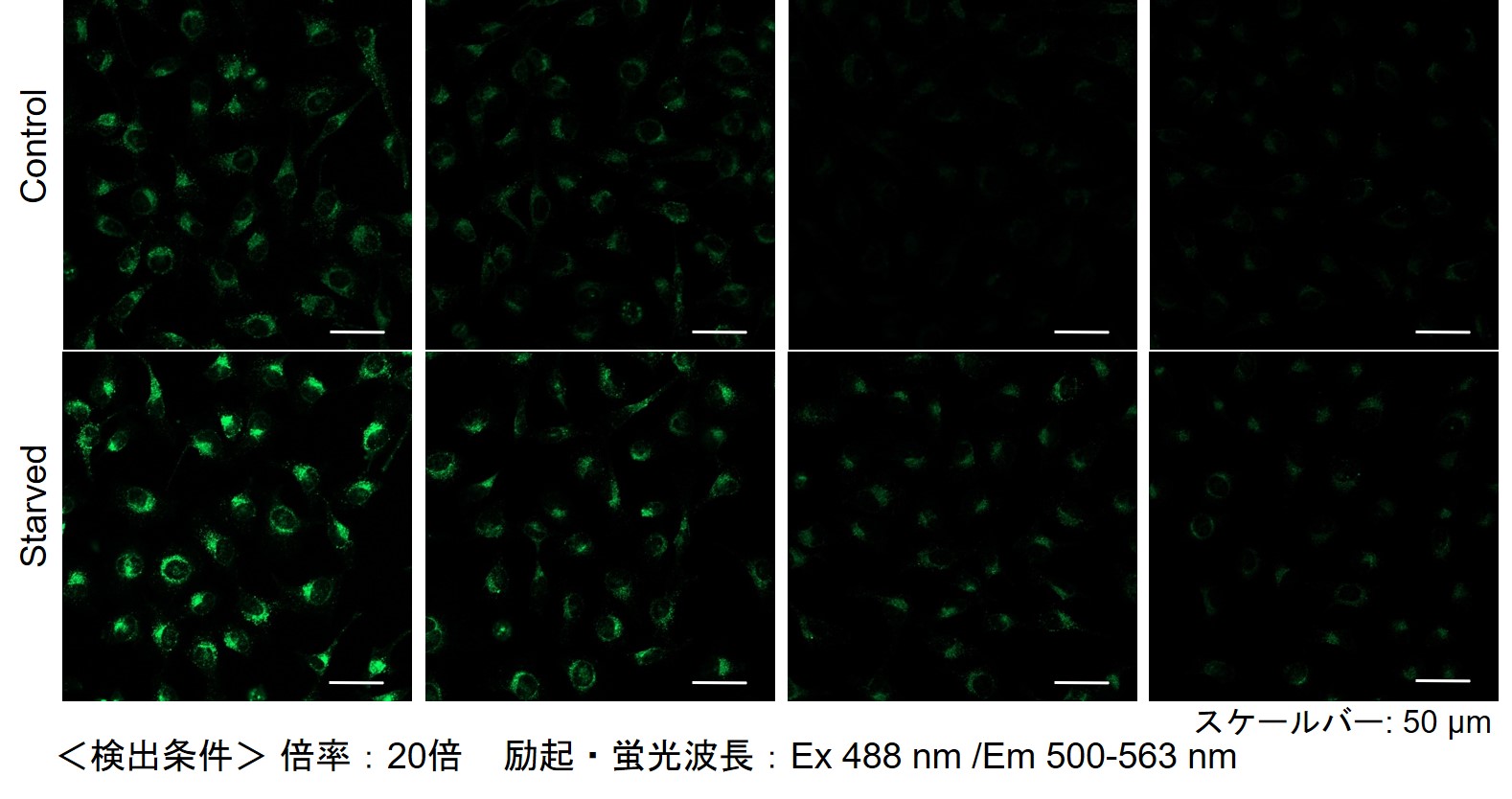
【CHO細胞】
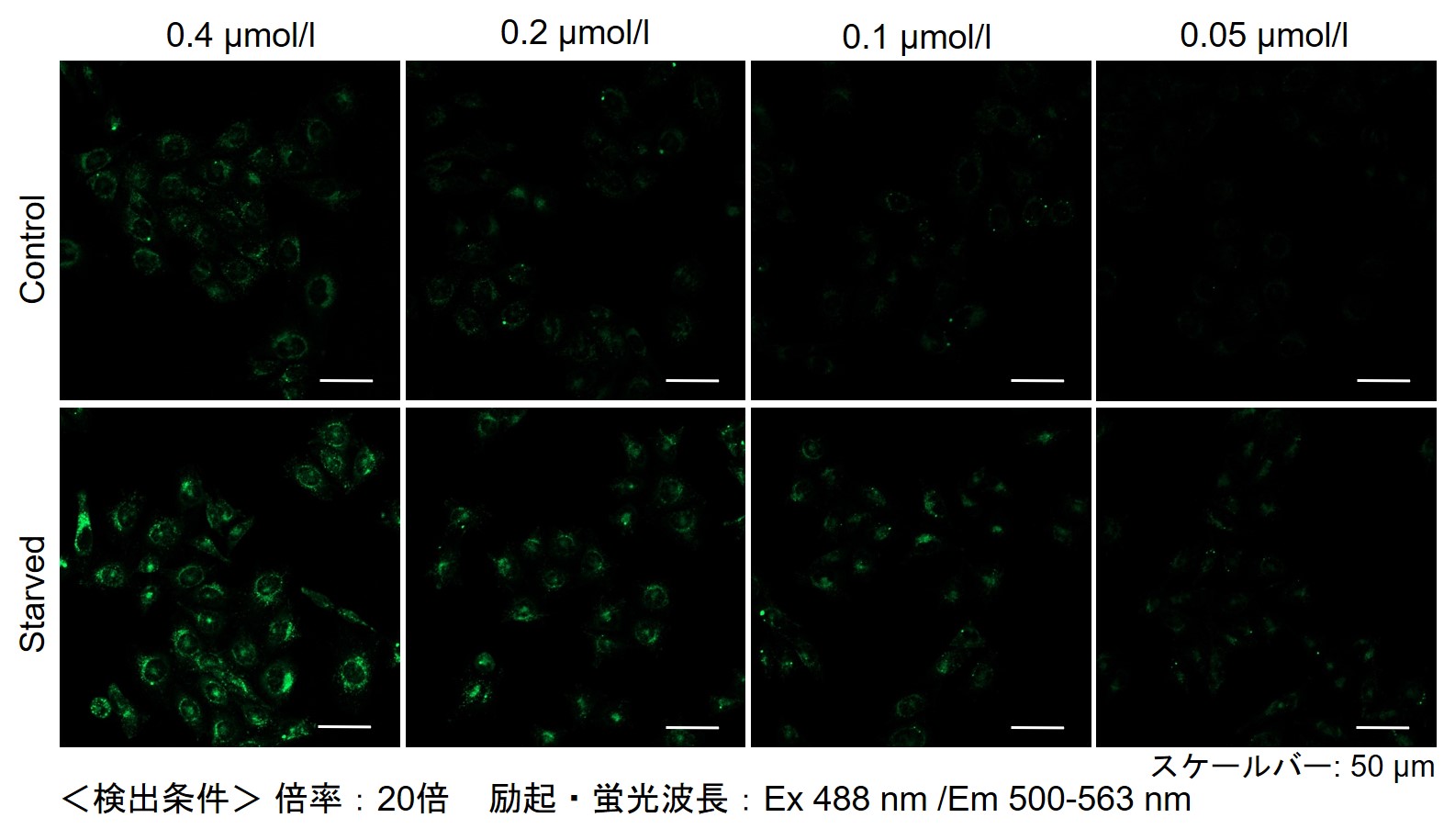
-
Q
プレートリーダーでの定量解析の測定条件を教えてください。
-
A
HeLa細胞を用いた測定例は下記となります。
DAPGreenで染色後のHeLa細胞を、アミノ酸不含培地にて0、2、4、6時間培養し、プレートリーダーにて検出
<操作>
1) 透明底のブラックプレートに細胞を播種 (HeLa cell, 1.6×10^4 cells/well, 100 µl/well)
2) 一晩培養(37℃, 5%CO2)
3) 上清を除き培地で調整したWorking solution(DAPGreen:0.1 µmo/l)を100 µl添加
4) 37℃で30分間インキュベート(37℃, 5%CO2)
5) 培地で洗浄(100 µl×2回)
6) 飢餓培地(富士フィルム和光純薬, code:048-33575)を添加(100 µl)
7) 37℃で各時間インキュベート
8) プレートリーダー(TECAN,infinite pro M200)で測定(Ex/Em=450/530nm)
(0minはHBSSに置換して測定)<結果>
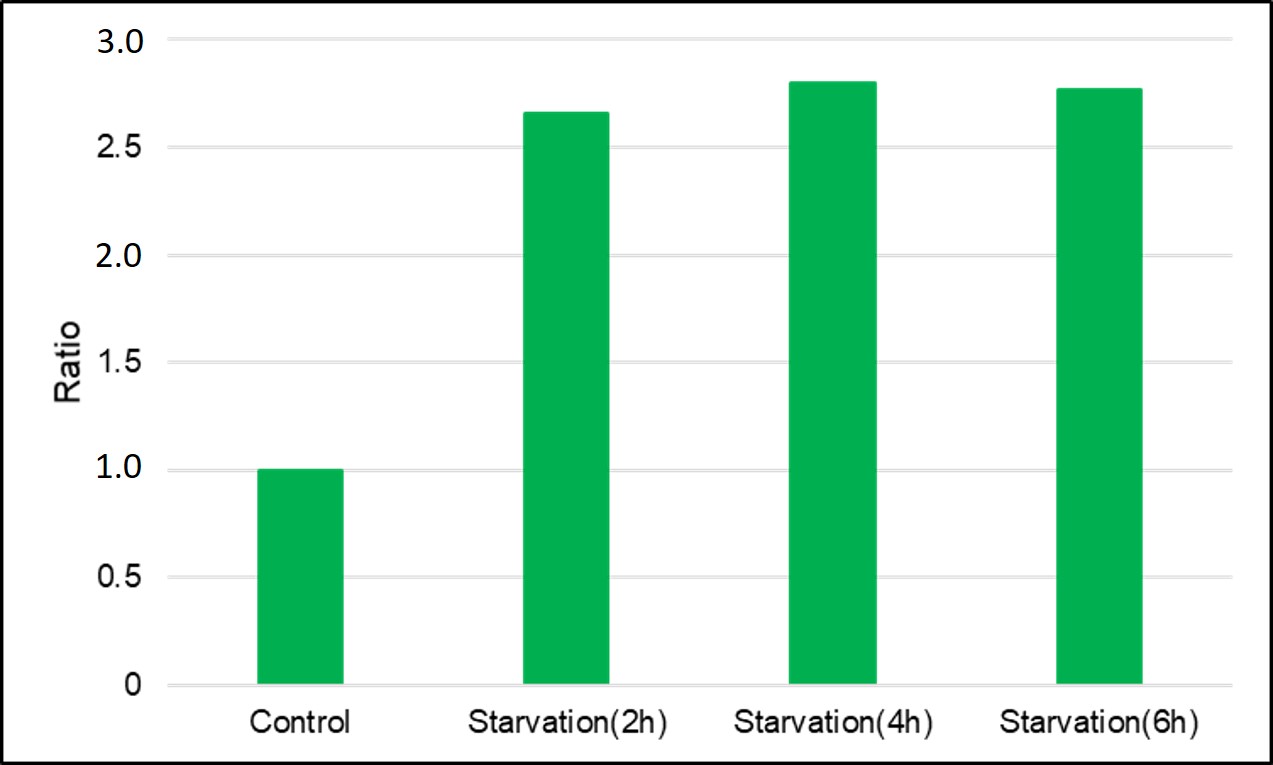 <検出条件> 波長 :Ex. 450 nm / Em. 535 nm
<検出条件> 波長 :Ex. 450 nm / Em. 535 nm飢餓培養を開始してから2時間後には、コントロールより約3.5倍強い蛍光を確認した。
-
Q
オートファジーにはどのような経路があり、 DAPGreenはどの状態を検出するのですか?
-
A
オートファジーには、Atg5依存的オートファジー(LC3が変化する)とLC3の変化を伴わない、Atg5非依存的オートファジーがあることが知られております*。
DAPGreenはオートファゴソーム膜に取り込まれ疎水環境下で蛍光を発し、オートファゴソームの状態を検出します。
*参考資料 : 新たなオートファジー機構の発見 清水重臣
▶初めて検出する細胞種や実験系の場合は、よくある問い合わせ【 DAPGreenの最適濃度の検討手順】をご参照ください。


取扱条件
| 性状: | 本品はメタノール及びジメチルスルホキシドに溶ける。 |
|---|---|
| 純度(HPLC): | 90.0% 以上 |
| 1.保存方法:冷凍,遮光, 2.窒素置換 |

関連製品
この製品に関連する研究では、下記の関連製品も使われています。
-

オートファジー(オートリソソーム)の検出試薬
DALGreen – Autophagy Detection
-

マイトファジー検出キット
Mitophagy Detection Kit
-
老化細胞検出キット
Cellular Senescence Detection Kit – SPiDER-βGal
-
細胞毒性測定キット
Cytotoxicity LDH Assay Kit-WST

