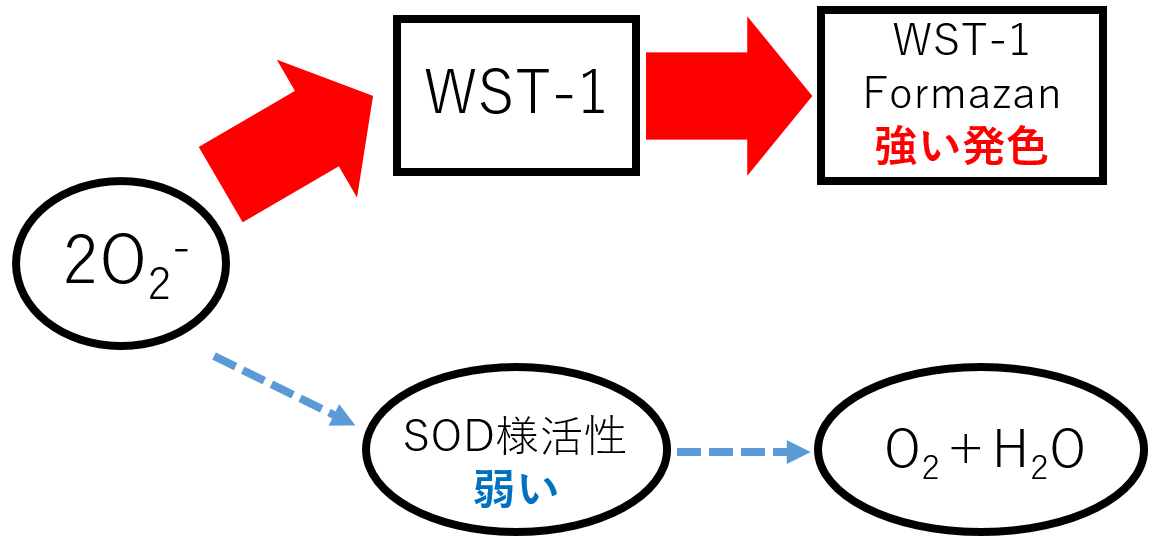
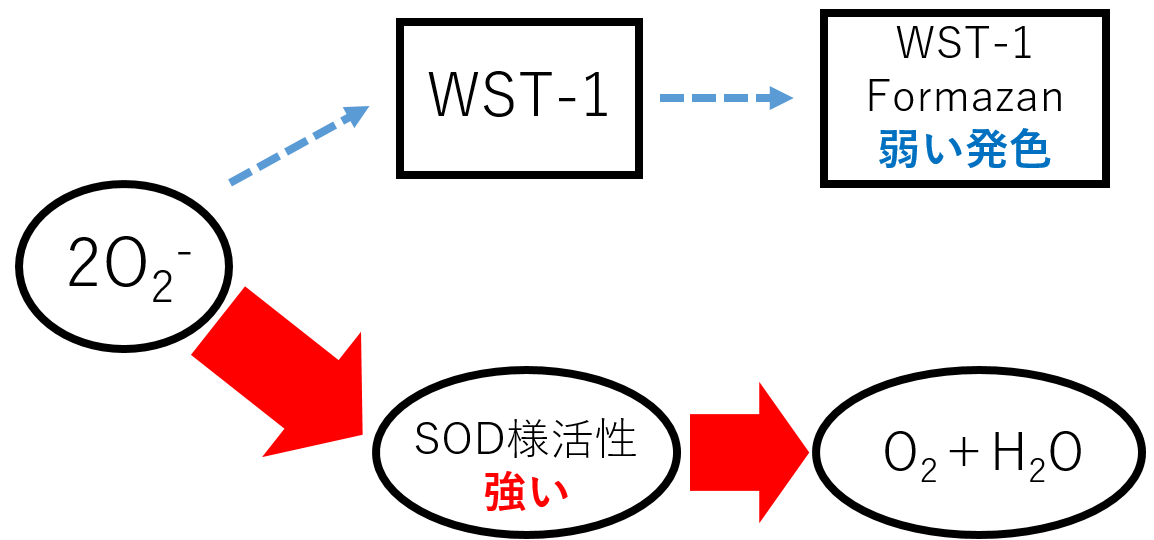
1) H. Ukeda, A. K. Sarker, D. Kawana and M. Sawamura, "Flow-Injection Assay of Superoxide Dismutase Based on the Reduction of Highly Water-Soluble Tetrazolium", Anal. Sci., 1999, 15, 353.
2) H. Ukeda, D. Kawana, S. Maeda and M. Sawamura, "Spectrophotometric Assay for Superoxide Dismutase Based on the Reduction of Highly Water-soluble Tetrazolium Salts by Xanthine-Xanthine Oxidase", Biosci. Biotechnol. Biochem., 1999, 63, 485.
3) <受田浩之, 森山洋憲, 川名大介, 片山泰幸, 中林錦一, 沢村正義, 「スーパーオキシドアニオン消去活性新規測定法の食品への応用」, 日本食品科学工学会誌, 2002,49, 25.
4) <森山洋憲, 片山泰幸, 中林錦一, 受田浩之, 沢村正義, 「高知県産茶および青果物の有するスーパーオキシドアニオン消去能の測定」, 日本食品科学工学会誌, 2002,49, 679.
5) H. Ukeda, T. Shimamura, M. Tsubouchi,Y. Harada, Y. Nakai and M. Sawamura, "Spectrophotometric Assay of Superoxide Anion Formed in Maillard Reaction Based on Highly Water-soluble Tetrazolium Salt", Anal. Sci., 2002, 18, 1151.
6) N. Tsuji, N. Hirayanagi, M. Okada, H. Miyasaka, K. Hirata, M. H. Zenk and K. Miyamoto, "Enhancement of Tolerance to Heavy Metals and Oxidative Stress in Dunaliella Tertiolecta by Zn-induced Phytochelatin Synthesis", Biochem. Biophys. Res. Commun., 2002, 293, 653.
7) A. Sakudo, D. C. Lee, K. Saeki, Y. Nakamura, K. Inoue, Y. Matsumoto, S. Itohara and T. Onodera, "Impairment of Superoxide Dismutase Activation by N-Terminally Truncated Prion Protein (PrP) in PrP-deficient Neuronal Cell Line", Biochem. Biophys. Res. Commun., 2003, 308, 660.
8) J.-H. Zhu, X. Zhang, J. P. Mcclung and X. G. Lei, "Impact of Cu,Zn-Superoxide Dismutase and Se-Dependent Glutathione Peroxidase-1 Knockouts on Acetaminophen-Induced Cell Death and Related Signaling in Murine Liver", Exp. Biol. Med., 2006, 231, 1726.
9) H. R. Rezvani, S. Dedieu, S. North, F. Belloc, R. Rossignol, T. Letellier, H. de Verneuil1, A. Taieb1, F.Mazurier, "HIF-1α: a Key Ffactor in the Keratinocyte Response to UVB Exposure", J. Biol. Chem., 2007, 10, 1074.
10) S. Goldstein and G. Czapski, "Comparison Between Different Assays for Superoxide Dismutase-like Activity", Free Rad. Res. Comms., 1991, 12, 5.
11) R. H. Burdon, V. Gill and C. Rice-Evans, "Reduction of a Tetrazolium Salt and Superoxide Generation in Human Tumor Cells (HeLa)", Free Rad. Res. Commun., 1993,18, 369.
12) Y. Sakurai, I. Anzai and Y. Furukawa, "A Primary Role for Disulfide Formation in the Productive Folding of Prokaryotic Cu,Zn-superoxide Dismutase", J. Biol. Chem., 2014, 289(29), 20139.
13) A. Weichert, A. S. Besemer, M. Liebl, N. Hellmann, I. Koziollek-Drechsler, P. Ip, H. Decker, J. Robertson, A. Chakrabartty, C. Behl and A. M. Clement, "Wild-type Cu/Zn superoxide dismutase stabilizes mutant variants by heterodimerization", Neurobiol. Dis., 2014, 62, 479.
14) J. M. Hartney, T. Stidham, D. A. Goldstrohm, R. E. Oberley-Deegan, M. R. Weaver, Z. Valnickova-Hansen, C. Scavenius, R. K.P. Benninger, K. F. Leahy, R. Johnson, F. Gally, B. Kosmider, A. K. Zimmermann, J. J. Enghild, E. Nozik-Grayck and R. P. Bowler, "A common polymorphism in extracellular superoxide dismutase affects cardiopulmonary disease risk by altering protein distribution", Circ Cardiovasc Genet, 2014, 7(5), 659.
15) J. Wu, Y. Sun, Y. Zhao, J. Zhang, L. Luo, M. Li, J. Wang, H. Yu, G. Liu, L. Yang, G. Xiong, J. Zhou, J. Zuo, Y. Wang and J. Li, "Deficient plastidic fatty acid synthesis triggers cell death by modulating mitochondrial reactive oxygen species", Cell Res., 2015, 25(5), 621.
16) E. Harunari, C. Imada, Y. Igarashi, "Konamycins A and B and Rubromycins CA1 and CA2, Aromatic Polyketides from the Tunicate-Derived Streptomyces hyaluromycini MB-PO13T'", J. Nat. Prod., 2019, 82, (6), 1609-1615.
17) N. Kajihara, D. Kukidome, K. Sada, H. Motoshima, N. Furukawa, T. Matsumura, T. Nishikawa and E. Araki, "Low glucose induces mitochondrial reactive oxygen species via fatty acid oxidation in bovine aortic endothelial cells", J Diabetes Investig, 2017, 8, (6), 750.
18) H- J. Kim, H- J. Kim, J. Jeon, K- C. Nam, K- S. Shim, J- H. Jung, K. S. Kim, Y. Choi, S- H. Kim, A. Jang, Comparison of the quality characteristics of chicken breast meat from conventional and animal welfare farms under refrigerated storage', Poultry Science., 2020, 99, 1788-1796.
19) T. Shoji, S. Masumoto, N. Moriichi, Y. Ohtake, T. Kanda, Administration of Apple Polyphenol Supplements for Skin Conditions in Healthy Women: A Randomized, Double-Blind, Placebo-Controlled Clinical Trial', Nutrients., 2020, 12, (1071), .
20) Y. Hirata, Y. Ito, M. Takashima, K Yagy, K. Oh-Hashi, H. Suzuki, K. Ono, K. Furuta and M. Sawada, Novel Oxindole-Curcumin Hybrid Compound for Antioxidative Stress and Neuroprotection.', ACS Chem. Neurosci.., 2020, 11, (1), 76-85.



 SOD Assay Kit – WST
SOD Assay Kit – WST